初中化学所涉及的元素化合物知识主要包括以O2、H2、C、S、P等为代表的非金属单质,以Fe、Cu、Na为代表的金属单质,以CO、CO2等为代表的非金属氧化物,以Fe2O3、CuO等为代表的金属氧化物,以H2SO4、HNO3、HCl为代表的酸,以NaOH、Ca(OH)2为代表的碱,以NaCl、CuSO4、Na2CO3、CaCO3为代表的盐。这些物质之间的相互转化关系可用下图描述。
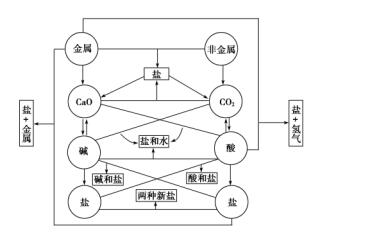 在初中化学中,通常把常见无机物分成单质、氧化物、酸、碱和盐等五大类。从结构和性质角度来分析,把无机物分成以下几类可能更合理些:①金属(包括游离的金属单质和合金),②非金属(非金属单质),③碱性物质(包括碱性氧化物和碱,基本上都是离子化合物),④酸性物质(包括酸性氧化物和酸,基本上都是共价化合物),⑤盐(都可以看成是碱性物质和酸性物质的反应产物)。 同一类物质一般有相似的性质,由于无机物种类不多,所以貌似复杂纷繁的无机化学反应,大多数可以归纳到以下三大类反应。 ①酸性物质和碱性物质之间的反应 性质对立的这两类物质,一般都能反应,反应生成盐或盐和水。 ②酸、碱、盐等电解质在溶液里的反应 反应过程中一般有水、沉淀和气体生成。 ③氧化还原反应 在结构上容易得电子的物质和容易失电子的物质之间的化学反应。 初中化学中,没有单质参加的反应大部分属于前两类化学反应,但都是以个别反应为示例,未形成一般性规律,使我们无法用来分析高中阶段所接触物质的基本性质。而反应物涉及单质的反应大多数为氧化还原反应,但反应本质的理解也不作为要求,氧化还原反应规律正是高中阶段接触的最重要的化学反应规律。 下面,我们将着重补充有关前两类反应的基本规律,以帮助我们更好地理解必修1中常见无机物的化学性质。 1.酸性物质和碱性物质的反应 (1)酸性物质和碱性物质 碱性物质包括碱和对应的碱性氧化物,除氨水外,结构上都可看成是由金属阳离子和OH-或O2-构成,状态上一般都是不挥发性固体。 酸性物质包括酸和酸性氧化物,酸又可分为无氧酸(如盐酸HCl、氢氟酸HF、氢硫酸H2S、氢氰酸HCN等)和含氧酸(如H2SO4、HNO3、H2CO3、H3PO4、高锰酸HMnO4、次氯酸HClO),无机含氧酸都是酸性氧化物的水化物;酸性氧化物又可分为非金属氧化物和金属氧化物(如CrO3、Mn2O7等)。酸性物质在结构上一般都是由分子构成(少量的直接以原子构成,如B2O3、SiO2),在水分子作用下,酸分子可被离解成氢离子和其他阴离子;酸性氧化物在水中并不会被直接离解成阴阳离子,但部分酸性氧化物会与水化合形成酸。中学阶段,大多数非金属酸性氧化物都是气体(P2O5、B2O3、SiO2是固体),而金属酸性氧化物大多是固体。 (2)酸性物质和碱性物质的反应 酸性物质和碱性物质之间可发生以下四种反应类型: 酸性氧化物+碱性氧化物===含氧酸盐 酸性氧化物+碱===盐+水 碱性氧化物+酸===盐+水 酸+碱===盐+水 从中可以看出,当反应物中只有氧化物时,生成物只有盐;而反应物中有酸或碱时,生成物是盐和水。 酸性物质跟碱性物质,两者的性质对立越强烈,也就是反应物间酸碱性差异越大,反应越容易发生。弱酸性物质和弱碱性物质,往往较难发生反应,如碳酸和氢氧化铁就不发生反应。 ①酸性氧化物和碱性氧化物生成含氧酸盐 酸碱性对立越强烈,两种氧化物间反应生成含氧酸盐就越容易发生,反过来,生成的含氧酸盐就越稳定,越难分解。参加反应的两种氧化物中,如果有一种是强酸性或强碱性的,反应往往都能进行。 Na2O+CO2===Na2CO3(Na2O是碱性较强的物质,对应水化物为烧碱) CaO+CO2===CaCO3(CaO是碱性较强的物质,对应水化物为熟石灰) CuO+SO3===CuSO4(SO3酸性较强,对应水化物为硫酸) 如果两种氧化物的酸、碱性都不强,它们一般不能发生反应,例如氧化铜跟二氧化碳就不能直接化合。 在这种反应类型中,人们还发现,极难挥发的酸性氧化物(如P2O5、B2O3、SiO2,其中SiO2熔点高达1 700 ℃左右,极高温度下也不挥发)跟碱性氧化物混合强热时能化合生成对应盐。如钢铁冶炼中的高温造渣反应,本质是SiO2和各种金属氧化物的反应。 CaO+SiO2===CaSiO3 FeO+SiO2===FeSiO3 ②碱性氧化物和酸的反应 碱性氧化物和酸的性质对立越强烈,反应越容易。不溶性碱性氧化物(对应水化物往往是弱碱,碱性较弱)一般不能跟极弱的酸(如碳酸、次氯酸HClO)反应。 碱性氧化物遇酸时,结构中的氧离子跟H+结合生成水,金属阳离子和酸根离子结合成盐。强酸能跟所有碱性氧化物反应,工业生产中常利用酸除去金属表面的氧化物锈斑,例如: Fe2O3+6HCl===2FeCl3+3H2O CuO+H2SO4===CuSO4+H2O 醋酸这类较强的弱酸,也几乎能跟所有碱性氧化物反应,如: Fe2O3+6CH3COOH===2(CH3COO)3Fe+3H2O ③酸性氧化物和碱的反应 酸性氧化物跟碱反应,一般生成盐和水。反应在溶液中进行时,可以看成酸性氧化物先跟水反应变成酸,酸再和碱反应生成盐和水。如: 2NaOH+CO2===Na2CO3+H2O(Na2CO3读作碳酸钠) 2NaOH+SO2===Na2SO3+H2O(Na2SO3读作亚硫酸钠) 两者性质对立越强,反应越容易,不溶性氢氧化物(大多为弱碱)一般不跟极弱的酸性氧化物(如CO2、SiO2)反应,像SiO2这种极弱的不溶性酸性氧化物跟强碱作用时反应也很慢,与强碱共熔时才有很好的反应,如硅酸钠、硅酸钾等盐常利用二氧化硅跟强碱共熔制备,硅酸钠、硅酸钾的水溶液有很强的粘性,俗称水玻璃,是常用的无机矿物胶。 2NaOH+SiO2强热(=====)Na2SiO3+H2O 2KOH+SiO2强热(=====)K2SiO3+H2O 其实,碱和酸性氧化物要生成盐和水,碱必须相对过量,酸性氧化物少量。如果反应中酸性氧化物过量,而碱不足时就只能生成酸式盐,如 NaOH+CO2===NaHCO3(NaHCO3读作碳酸氢钠) NaOH+SO2===NaHSO3(NaHSO3读作亚硫酸氢钠) [试一试] 1.写出氨水(NH3·H2O)和CO2生成正盐和酸式盐的两种化学反应方程式。 由此可见,酸性氧化物和碱反应生成物与其相对量有关,相对量不同,生成的盐也不同,导致基于此类反应的有关实验制备、化学计算更趋复杂。 ④酸跟碱的反应 酸跟碱的反应,本质上是酸组成中的H+与碱组成中的OH-结合成水,金属阳离子(或铵根离子)与酸根离子结合成盐。酸和碱生成盐和水的反应,又称为中和反应,它是最典型的复分解反应之一。 NaOH+HCl===NaCl+H2O NaOH+HClO===NaClO+H2O(HClO读次氯酸,为弱酸) NaOH+CH3COOH===CH3COONa+H2O NaOH+HNO2===NaNO2+H2O(HNO2读亚硝酸,为弱酸) 2NaOH+H2SO4===Na2SO4+2H2O 酸和碱的性质对立越强,反应越容易,一般只有极弱的酸跟极弱的碱之间才不会反应,其他酸和碱一般都能反应,例如不溶性氢氧化物一般不溶于碳酸、硅酸等极弱的酸溶液。 2.酸、碱、盐等电解质在溶液里的反应 碱、酸和盐在水溶液里全部或部分电离成离子,都是电解质,在溶液里可两两反应。其中酸和碱的反应称为中和反应,生成水是相互间反应的基本条件。另外,酸和盐、碱和盐也能发生反应,其反应规律分别如下。 (1)酸和盐的反应 在中学阶段,我们所接触的酸以可溶性酸为主,溶质在水中电离成氢离子和酸根离子,当向其中加入盐时,只要其中任何一种离子的浓度能降低,盐和酸的反应就能发生。 在盐酸中加入碳酸钠固体,因为碳酸钠在水中可电离出碳酸根离子,它和H+能快速结合成不稳定的碳酸,分解成CO2和水,导致该反应发生。同样,加入碳酸钙或碳酸钡固体时,虽然固体溶解度不大,但溶解部分电离产生的碳酸根仍能和H+结合,所以照样可以反应,不过相同条件下产生气泡不如碳酸钠剧烈。其反应方程式如下: Na2CO3+2HCl===2NaCl+CO2↑+H2O BaCO3+2HCl===BaCl2+CO2↑+H2O 在硫酸中加入醋酸钠固体时,醋酸钠在水中可电离出醋酸根离子,它和H+结合形成醋酸(一种弱酸,水溶液中主要以分子形态存在),这将大大降低了H+浓度,促成反应进行到底。次氯酸钠、磷酸钠等弱酸盐和硫酸、盐酸等强酸的反应原理与此相似,习惯上被初中化学教师概括为强酸制弱酸。反应方程式如下: 2CH3COONa+H2SO4===Na2SO4+2CH3COOH 2NaClO+H2SO4===Na2SO4+2HClO [试一试] 2.一定条件下,稀硫酸和氯化钡溶液,氯化钠与硝酸银溶液混合都有白色沉淀生成,写出反应方程式,说明反应充分进行的理由。 向硫酸铜溶液中,滴入新制的饱和氢硫酸(H2S、二元弱酸)时,能观察到黑色沉淀,表明二者能发生化学反应,其反应方程式如下: CuSO4+H2S===H2SO4+CuS ↓ 该反应的发生证明,弱酸在一定条件下也可生成强酸,所以“强酸制备弱酸”规律是有缺陷的、不严密的、有条件的。从本质上看,硫酸铜电离产生的Cu2+能和氢硫酸部分电离产生的S2-形成难溶于水(也难溶于酸)的CuS沉淀,铜离子浓度降低,反应能够发生。从表面看,这一反应发生的理由仍然是因为生成物出现了不溶性沉淀物,降低了离子浓度。 (2)碱和盐的反应 一定条件下,在氯化铁溶液中滴加氢氧化钠溶液可以产生红褐色沉淀,该反应往往被用来验证溶液中是否存在铁离子,其反应方程式是FeCl3+3NaOH===Fe(OH)3↓+3NaCl。工业生产中,通过向氢氧化钙悬浊液中加入饱和碳酸钠溶液制备烧碱,其反应方程式是Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。向氯化铵稀溶液中加入烧碱固体,能放出有刺激性气味的氨气,这是铵盐的一个重要性质,其反应方程式是NH4Cl+NaOH===NaCl+NH3↑+H2O。 一般来说,盐和碱的反应中,两种反应物都是可溶性化合物,如果都不溶解,反应将很难进行。 (3)盐和盐的反应 酸和酸、碱和碱、盐和盐理论上也可能发生反应,酸和酸、碱和碱的反应,反应原理复杂,在高中化学中会逐步接触个别案例;而盐与盐的反应在初中化学中已有接触,在高中会增加更多案例。 如我们熟知的硝酸银与氯化钠的反应,被用来检验溶液中是否存在氯离子;氯化钡和硫酸钠的反应,被用来检验溶液中是否存在硫酸根离子;碳酸钠和氯化钡溶液混合时也会产生白色沉淀。目前所接触的案例中,大多数盐和盐的反应均发生在两种可溶性盐之间,在高中选修“化学反应原理”模块,会学习不溶性盐和另一种可溶性盐溶液之间的反应,如分析化学中常用饱和碳酸钠溶液处理硫酸钡固体,将不溶于水的硫酸钡转化为可溶于酸的碳酸钡,这种反应方式常被用于无机化合物的制备、提纯和废水处理中。 以上发生在溶液中的两种化合物间的反应,如碱性氧化物和酸、酸和碱、酸和盐、碱和盐、盐和盐的反应,都是两种电解质之间的反应,两种化合物先“分解”成两种成分(阳离子和阴离子),再重组为两种新的化合物,这类反应习惯上称为复分解反应。理论上,任何两种电解质,只要彼此组分中的阴阳离子都不相同,相互交换组成又能形成沉淀(溶解度更小的物质)、气体(挥发性物质)、水(高中化学将此扩展为水、醋酸等弱电解质)等产物,就有可能发生复分解反应。从形式上看,形成沉淀、气体或水是复分解反应发生的三种主要原因;从本质上看都是通过降低原反应物中某种离子的浓度而实现的。 3.氧化物跟其对应水化物间的相互转化 含氧酸和碱分别是酸性氧化物和碱性氧化物的水化物(和水化合形成产物的简称),它们之间往往有如下转换关系: 碱性氧化物+水―→碱 酸性氧化物+水―→酸 下面综合讨论氧化物与其水化物间的转化规律。 (1)碱性氧化物和碱之间的相互转化 大部分碱性氧化物不能跟水直接化合成对应的水化物,一般来说,只有可溶性碱才可以此碱性氧化物和水直接化合形成,中强碱氢氧化镁也适用此规律,但化合速率不如可溶性的烧碱。例如: Na2O+H2O===2NaOH MgO+H2O===Mg(OH)2 碱性氧化物跟水接触时,在水分子作用下,晶体中的金属离子和氧离子被水分子入侵后离解成自由移动的离子,其中的氧离子被水中微量的H+捕获成为OH-,这样就使氧化物转变成碱。 碱在加热时一般可分解为碱性氧化物和水,其分解倾向与碱性氧化物和水结合倾向的强弱相反。一般地说,越容易由碱性氧化物和水化合生成的碱就越难分解,也就是说,可溶性碱一般加热不分解,而不溶性碱加热时可分解成碱性氧化物和水。强碱类的氢氧化钙要强热才分解,中强碱的氢氧化镁在加热时可分解,氢氧化铜在热水中就可分解成黑色沉淀,而氢氧化银极不稳定,在含Ag+的溶液中加入碱,析出的氢氧化物马上分解成氧化物,只能得到氧化物(Cu+、Hg2+与Ag+类似)。 Ca(OH)2强热(=====)CaO+H2O Mg(OH)2加热(=====)MgO+H2O Cu(OH)2热水(=====)CuO+H2O 总之,一般可溶性碱可由其氧化物和水化合形成,高温也难分解;不溶性碱不能由其氧化物与水化合形成,但受热会分解成对应氧化物和水。 (2)酸性氧化物和酸之间的相互转化 一般来说,可溶于水的酸性氧化物都能和水直接化合成对应的含氧酸(元素有相同的价态)。例如: SO3+H2O===H2SO4 SO2+H2O===H2SO3 而不溶性氧化物(如SiO2,沙子、石英、水晶的主要成分)一般和水就不能直接化合,因此对应含氧酸H2SiO3就只能用其他方法合成。二氧化钛(TiO2)、三氧化钨(WO3)等酸性氧化物不能和水化合的原因与此相似。制取二氧化硅可以和氧化钠或氢氧化钠反应得到硅酸钠,硅酸钠再和盐酸、稀硫酸等酸发生反应转化为硅酸,即SiO2→Na2SiO3→H2SiO3两步完成转化。 [试一试] 3.以SiO2和其他常见试剂为原料,制取硅酸,写出相应的化学反应方程式。 绝大部分含氧酸能分解成对应的氧化物(被形象地称为酸酐)和水。对应酸酐不挥发、不溶解(难溶或微溶)的,容易受热分解成酸酐和水,如硅酸、磷酸;对应酸酐为低价态气体的,只能存在于溶液中,也就是极易分解,如碳酸、亚硫酸。 H2SiO3△(=====)SiO2+H2O H2SO3=====SO2+H2O [试一试] 4.HNO2也只能在稀溶液中存在,已知亚硝酸钠溶液和硫酸可以发生复分解反应,请写出相应的化学反应方程式。,初中化学
在初中化学中,通常把常见无机物分成单质、氧化物、酸、碱和盐等五大类。从结构和性质角度来分析,把无机物分成以下几类可能更合理些:①金属(包括游离的金属单质和合金),②非金属(非金属单质),③碱性物质(包括碱性氧化物和碱,基本上都是离子化合物),④酸性物质(包括酸性氧化物和酸,基本上都是共价化合物),⑤盐(都可以看成是碱性物质和酸性物质的反应产物)。 同一类物质一般有相似的性质,由于无机物种类不多,所以貌似复杂纷繁的无机化学反应,大多数可以归纳到以下三大类反应。 ①酸性物质和碱性物质之间的反应 性质对立的这两类物质,一般都能反应,反应生成盐或盐和水。 ②酸、碱、盐等电解质在溶液里的反应 反应过程中一般有水、沉淀和气体生成。 ③氧化还原反应 在结构上容易得电子的物质和容易失电子的物质之间的化学反应。 初中化学中,没有单质参加的反应大部分属于前两类化学反应,但都是以个别反应为示例,未形成一般性规律,使我们无法用来分析高中阶段所接触物质的基本性质。而反应物涉及单质的反应大多数为氧化还原反应,但反应本质的理解也不作为要求,氧化还原反应规律正是高中阶段接触的最重要的化学反应规律。 下面,我们将着重补充有关前两类反应的基本规律,以帮助我们更好地理解必修1中常见无机物的化学性质。 1.酸性物质和碱性物质的反应 (1)酸性物质和碱性物质 碱性物质包括碱和对应的碱性氧化物,除氨水外,结构上都可看成是由金属阳离子和OH-或O2-构成,状态上一般都是不挥发性固体。 酸性物质包括酸和酸性氧化物,酸又可分为无氧酸(如盐酸HCl、氢氟酸HF、氢硫酸H2S、氢氰酸HCN等)和含氧酸(如H2SO4、HNO3、H2CO3、H3PO4、高锰酸HMnO4、次氯酸HClO),无机含氧酸都是酸性氧化物的水化物;酸性氧化物又可分为非金属氧化物和金属氧化物(如CrO3、Mn2O7等)。酸性物质在结构上一般都是由分子构成(少量的直接以原子构成,如B2O3、SiO2),在水分子作用下,酸分子可被离解成氢离子和其他阴离子;酸性氧化物在水中并不会被直接离解成阴阳离子,但部分酸性氧化物会与水化合形成酸。中学阶段,大多数非金属酸性氧化物都是气体(P2O5、B2O3、SiO2是固体),而金属酸性氧化物大多是固体。 (2)酸性物质和碱性物质的反应 酸性物质和碱性物质之间可发生以下四种反应类型: 酸性氧化物+碱性氧化物===含氧酸盐 酸性氧化物+碱===盐+水 碱性氧化物+酸===盐+水 酸+碱===盐+水 从中可以看出,当反应物中只有氧化物时,生成物只有盐;而反应物中有酸或碱时,生成物是盐和水。 酸性物质跟碱性物质,两者的性质对立越强烈,也就是反应物间酸碱性差异越大,反应越容易发生。弱酸性物质和弱碱性物质,往往较难发生反应,如碳酸和氢氧化铁就不发生反应。 ①酸性氧化物和碱性氧化物生成含氧酸盐 酸碱性对立越强烈,两种氧化物间反应生成含氧酸盐就越容易发生,反过来,生成的含氧酸盐就越稳定,越难分解。参加反应的两种氧化物中,如果有一种是强酸性或强碱性的,反应往往都能进行。 Na2O+CO2===Na2CO3(Na2O是碱性较强的物质,对应水化物为烧碱) CaO+CO2===CaCO3(CaO是碱性较强的物质,对应水化物为熟石灰) CuO+SO3===CuSO4(SO3酸性较强,对应水化物为硫酸) 如果两种氧化物的酸、碱性都不强,它们一般不能发生反应,例如氧化铜跟二氧化碳就不能直接化合。 在这种反应类型中,人们还发现,极难挥发的酸性氧化物(如P2O5、B2O3、SiO2,其中SiO2熔点高达1 700 ℃左右,极高温度下也不挥发)跟碱性氧化物混合强热时能化合生成对应盐。如钢铁冶炼中的高温造渣反应,本质是SiO2和各种金属氧化物的反应。 CaO+SiO2===CaSiO3 FeO+SiO2===FeSiO3 ②碱性氧化物和酸的反应 碱性氧化物和酸的性质对立越强烈,反应越容易。不溶性碱性氧化物(对应水化物往往是弱碱,碱性较弱)一般不能跟极弱的酸(如碳酸、次氯酸HClO)反应。 碱性氧化物遇酸时,结构中的氧离子跟H+结合生成水,金属阳离子和酸根离子结合成盐。强酸能跟所有碱性氧化物反应,工业生产中常利用酸除去金属表面的氧化物锈斑,例如: Fe2O3+6HCl===2FeCl3+3H2O CuO+H2SO4===CuSO4+H2O 醋酸这类较强的弱酸,也几乎能跟所有碱性氧化物反应,如: Fe2O3+6CH3COOH===2(CH3COO)3Fe+3H2O ③酸性氧化物和碱的反应 酸性氧化物跟碱反应,一般生成盐和水。反应在溶液中进行时,可以看成酸性氧化物先跟水反应变成酸,酸再和碱反应生成盐和水。如: 2NaOH+CO2===Na2CO3+H2O(Na2CO3读作碳酸钠) 2NaOH+SO2===Na2SO3+H2O(Na2SO3读作亚硫酸钠) 两者性质对立越强,反应越容易,不溶性氢氧化物(大多为弱碱)一般不跟极弱的酸性氧化物(如CO2、SiO2)反应,像SiO2这种极弱的不溶性酸性氧化物跟强碱作用时反应也很慢,与强碱共熔时才有很好的反应,如硅酸钠、硅酸钾等盐常利用二氧化硅跟强碱共熔制备,硅酸钠、硅酸钾的水溶液有很强的粘性,俗称水玻璃,是常用的无机矿物胶。 2NaOH+SiO2强热(=====)Na2SiO3+H2O 2KOH+SiO2强热(=====)K2SiO3+H2O 其实,碱和酸性氧化物要生成盐和水,碱必须相对过量,酸性氧化物少量。如果反应中酸性氧化物过量,而碱不足时就只能生成酸式盐,如 NaOH+CO2===NaHCO3(NaHCO3读作碳酸氢钠) NaOH+SO2===NaHSO3(NaHSO3读作亚硫酸氢钠) [试一试] 1.写出氨水(NH3·H2O)和CO2生成正盐和酸式盐的两种化学反应方程式。 由此可见,酸性氧化物和碱反应生成物与其相对量有关,相对量不同,生成的盐也不同,导致基于此类反应的有关实验制备、化学计算更趋复杂。 ④酸跟碱的反应 酸跟碱的反应,本质上是酸组成中的H+与碱组成中的OH-结合成水,金属阳离子(或铵根离子)与酸根离子结合成盐。酸和碱生成盐和水的反应,又称为中和反应,它是最典型的复分解反应之一。 NaOH+HCl===NaCl+H2O NaOH+HClO===NaClO+H2O(HClO读次氯酸,为弱酸) NaOH+CH3COOH===CH3COONa+H2O NaOH+HNO2===NaNO2+H2O(HNO2读亚硝酸,为弱酸) 2NaOH+H2SO4===Na2SO4+2H2O 酸和碱的性质对立越强,反应越容易,一般只有极弱的酸跟极弱的碱之间才不会反应,其他酸和碱一般都能反应,例如不溶性氢氧化物一般不溶于碳酸、硅酸等极弱的酸溶液。 2.酸、碱、盐等电解质在溶液里的反应 碱、酸和盐在水溶液里全部或部分电离成离子,都是电解质,在溶液里可两两反应。其中酸和碱的反应称为中和反应,生成水是相互间反应的基本条件。另外,酸和盐、碱和盐也能发生反应,其反应规律分别如下。 (1)酸和盐的反应 在中学阶段,我们所接触的酸以可溶性酸为主,溶质在水中电离成氢离子和酸根离子,当向其中加入盐时,只要其中任何一种离子的浓度能降低,盐和酸的反应就能发生。 在盐酸中加入碳酸钠固体,因为碳酸钠在水中可电离出碳酸根离子,它和H+能快速结合成不稳定的碳酸,分解成CO2和水,导致该反应发生。同样,加入碳酸钙或碳酸钡固体时,虽然固体溶解度不大,但溶解部分电离产生的碳酸根仍能和H+结合,所以照样可以反应,不过相同条件下产生气泡不如碳酸钠剧烈。其反应方程式如下: Na2CO3+2HCl===2NaCl+CO2↑+H2O BaCO3+2HCl===BaCl2+CO2↑+H2O 在硫酸中加入醋酸钠固体时,醋酸钠在水中可电离出醋酸根离子,它和H+结合形成醋酸(一种弱酸,水溶液中主要以分子形态存在),这将大大降低了H+浓度,促成反应进行到底。次氯酸钠、磷酸钠等弱酸盐和硫酸、盐酸等强酸的反应原理与此相似,习惯上被初中化学教师概括为强酸制弱酸。反应方程式如下: 2CH3COONa+H2SO4===Na2SO4+2CH3COOH 2NaClO+H2SO4===Na2SO4+2HClO [试一试] 2.一定条件下,稀硫酸和氯化钡溶液,氯化钠与硝酸银溶液混合都有白色沉淀生成,写出反应方程式,说明反应充分进行的理由。 向硫酸铜溶液中,滴入新制的饱和氢硫酸(H2S、二元弱酸)时,能观察到黑色沉淀,表明二者能发生化学反应,其反应方程式如下: CuSO4+H2S===H2SO4+CuS ↓ 该反应的发生证明,弱酸在一定条件下也可生成强酸,所以“强酸制备弱酸”规律是有缺陷的、不严密的、有条件的。从本质上看,硫酸铜电离产生的Cu2+能和氢硫酸部分电离产生的S2-形成难溶于水(也难溶于酸)的CuS沉淀,铜离子浓度降低,反应能够发生。从表面看,这一反应发生的理由仍然是因为生成物出现了不溶性沉淀物,降低了离子浓度。 (2)碱和盐的反应 一定条件下,在氯化铁溶液中滴加氢氧化钠溶液可以产生红褐色沉淀,该反应往往被用来验证溶液中是否存在铁离子,其反应方程式是FeCl3+3NaOH===Fe(OH)3↓+3NaCl。工业生产中,通过向氢氧化钙悬浊液中加入饱和碳酸钠溶液制备烧碱,其反应方程式是Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。向氯化铵稀溶液中加入烧碱固体,能放出有刺激性气味的氨气,这是铵盐的一个重要性质,其反应方程式是NH4Cl+NaOH===NaCl+NH3↑+H2O。 一般来说,盐和碱的反应中,两种反应物都是可溶性化合物,如果都不溶解,反应将很难进行。 (3)盐和盐的反应 酸和酸、碱和碱、盐和盐理论上也可能发生反应,酸和酸、碱和碱的反应,反应原理复杂,在高中化学中会逐步接触个别案例;而盐与盐的反应在初中化学中已有接触,在高中会增加更多案例。 如我们熟知的硝酸银与氯化钠的反应,被用来检验溶液中是否存在氯离子;氯化钡和硫酸钠的反应,被用来检验溶液中是否存在硫酸根离子;碳酸钠和氯化钡溶液混合时也会产生白色沉淀。目前所接触的案例中,大多数盐和盐的反应均发生在两种可溶性盐之间,在高中选修“化学反应原理”模块,会学习不溶性盐和另一种可溶性盐溶液之间的反应,如分析化学中常用饱和碳酸钠溶液处理硫酸钡固体,将不溶于水的硫酸钡转化为可溶于酸的碳酸钡,这种反应方式常被用于无机化合物的制备、提纯和废水处理中。 以上发生在溶液中的两种化合物间的反应,如碱性氧化物和酸、酸和碱、酸和盐、碱和盐、盐和盐的反应,都是两种电解质之间的反应,两种化合物先“分解”成两种成分(阳离子和阴离子),再重组为两种新的化合物,这类反应习惯上称为复分解反应。理论上,任何两种电解质,只要彼此组分中的阴阳离子都不相同,相互交换组成又能形成沉淀(溶解度更小的物质)、气体(挥发性物质)、水(高中化学将此扩展为水、醋酸等弱电解质)等产物,就有可能发生复分解反应。从形式上看,形成沉淀、气体或水是复分解反应发生的三种主要原因;从本质上看都是通过降低原反应物中某种离子的浓度而实现的。 3.氧化物跟其对应水化物间的相互转化 含氧酸和碱分别是酸性氧化物和碱性氧化物的水化物(和水化合形成产物的简称),它们之间往往有如下转换关系: 碱性氧化物+水―→碱 酸性氧化物+水―→酸 下面综合讨论氧化物与其水化物间的转化规律。 (1)碱性氧化物和碱之间的相互转化 大部分碱性氧化物不能跟水直接化合成对应的水化物,一般来说,只有可溶性碱才可以此碱性氧化物和水直接化合形成,中强碱氢氧化镁也适用此规律,但化合速率不如可溶性的烧碱。例如: Na2O+H2O===2NaOH MgO+H2O===Mg(OH)2 碱性氧化物跟水接触时,在水分子作用下,晶体中的金属离子和氧离子被水分子入侵后离解成自由移动的离子,其中的氧离子被水中微量的H+捕获成为OH-,这样就使氧化物转变成碱。 碱在加热时一般可分解为碱性氧化物和水,其分解倾向与碱性氧化物和水结合倾向的强弱相反。一般地说,越容易由碱性氧化物和水化合生成的碱就越难分解,也就是说,可溶性碱一般加热不分解,而不溶性碱加热时可分解成碱性氧化物和水。强碱类的氢氧化钙要强热才分解,中强碱的氢氧化镁在加热时可分解,氢氧化铜在热水中就可分解成黑色沉淀,而氢氧化银极不稳定,在含Ag+的溶液中加入碱,析出的氢氧化物马上分解成氧化物,只能得到氧化物(Cu+、Hg2+与Ag+类似)。 Ca(OH)2强热(=====)CaO+H2O Mg(OH)2加热(=====)MgO+H2O Cu(OH)2热水(=====)CuO+H2O 总之,一般可溶性碱可由其氧化物和水化合形成,高温也难分解;不溶性碱不能由其氧化物与水化合形成,但受热会分解成对应氧化物和水。 (2)酸性氧化物和酸之间的相互转化 一般来说,可溶于水的酸性氧化物都能和水直接化合成对应的含氧酸(元素有相同的价态)。例如: SO3+H2O===H2SO4 SO2+H2O===H2SO3 而不溶性氧化物(如SiO2,沙子、石英、水晶的主要成分)一般和水就不能直接化合,因此对应含氧酸H2SiO3就只能用其他方法合成。二氧化钛(TiO2)、三氧化钨(WO3)等酸性氧化物不能和水化合的原因与此相似。制取二氧化硅可以和氧化钠或氢氧化钠反应得到硅酸钠,硅酸钠再和盐酸、稀硫酸等酸发生反应转化为硅酸,即SiO2→Na2SiO3→H2SiO3两步完成转化。 [试一试] 3.以SiO2和其他常见试剂为原料,制取硅酸,写出相应的化学反应方程式。 绝大部分含氧酸能分解成对应的氧化物(被形象地称为酸酐)和水。对应酸酐不挥发、不溶解(难溶或微溶)的,容易受热分解成酸酐和水,如硅酸、磷酸;对应酸酐为低价态气体的,只能存在于溶液中,也就是极易分解,如碳酸、亚硫酸。 H2SiO3△(=====)SiO2+H2O H2SO3=====SO2+H2O [试一试] 4.HNO2也只能在稀溶液中存在,已知亚硝酸钠溶液和硫酸可以发生复分解反应,请写出相应的化学反应方程式。,初中化学
中考如何在仅剩的两个月提高化学分数,打好中考第一枪 考前2个月 复习是关键 1、了解自己 明确目标 进入下学期,同学们一定要评估自己的学习水平,清楚自己的学习状况,明确自己的中考目标并对目标分解,才能快人一步制胜中考。 第一步就是要找好自己的位置,通过对自己过去成绩的分析,合理定位,锁定合理的目标。要找准自己在班级、年级中的位置,树立一个通过自己努力可能实现的目标,才更有信心;否则,盲目地制定过高的目标、与别人比较只能打击自信心。了解自己的现状,对自己作出客观的分析,是制订切实有效的计划的前提。才能确定在关键学期中的主攻方向。 2、制订详细计划 光有目标还不行,还要有实现目标的计划,将大的目标分解成小目标。有的学生喜欢打疲劳战,认为学的时间越长,学的东西就越多,这是不可取的。人的精力有限,如果过度疲惫,学习效率就会降低。建议同学们制定一个每日学习计划表,按计划复习,将大目标分解为各个小目标,如月考要达到的成绩、一模考试要达到的成绩等。这样有助于合理安排作息时间,既能安排好各科复习,又能保证充足睡眠。 3、 关注效率 学会自律,丢掉浪费你时间的事件。 在初三下学期的复习过程中,中考实验复习、体育训练,这两项又不可防止地占用学生的复习时间。所以,提升效率就是个很关键的事情了!要学会体育训练和文化课学习交替进行、理科知识和文科知识交替进行的复习方式,这样才能“张弛有度、劳逸联合”。 4、发现问题 其实整个复习的过程就是不断对我们自身知识体系进行发现问题——解决问题的循环过程,这也是复习最重要的两个环节,一定要做好。 发现问题的两种重要手段就是查漏补缺和总结归纳。 查漏补缺 是指对自己所学的内容不足和缺陷进行整理和检查,这个工作的主题就是查找自己学习的漏洞和薄弱环节。最常用的方式就是进行错题整理、试卷分析。现在个阶段的考试,其实就是对当前阶段知识点的掌握程度的一个考察,分数就是最直观的表现。在每一次的分析中,就是发现自己薄弱环节的时候,然后根据自己的情况进行针对性的补充和练习,是“防患于未然”的根本举措。 总结归纳 是指对自己所学过的内容进行阶段性的回顾。这是使知识条理化、网络化和立体化的关键一环。 可从两方面进行总结: (一)内容上,分科、按体系、分章节。 (二)时间上,每节课后、每次作业后、每轮测验后、每日、每周、每月,都应及时梳理、巩固知识点。 最好每天睡觉前理一理今天复习了什么,学到了什么,睡觉是一个很好的学习过程,通过睡前的小结,会使内容更加印象深刻。 5、解决问题 解决疑难和困惑的手段和办法是以下四种: 提问 由于对某些概念或问题还存在疑问和不解,需要向老师或家长进行请教的过程。 讨论 与同学之间的讨论和交流是非常必要的,是发现自己问题的一个快捷方式,更是提高自己对概念等理解的好方法啊。不要担心同学从你那里得到学问,应该担心的是你能不能给同学讲清楚你自以为掌握的内容。 思索 其实是一种自己与自己的对话和交流,通过自我深省,来达到对问题的更好的认识和理解。最好每天晚上睡觉之前想想今天的事情哪些做好了,哪些又没有做,什么时候去做,心里要有个安排。 针对练习 通过查漏补缺和总结归纳发现有些概念点掌握的不是很好,所以做一些针对性的练习和作业来达到掌握的目的。有的练习是以背诵、记忆为主,有的则需要同学们自己通过参考书、习题册来安排、组织进行的,这是自学能力的高度表现。
